한국의 의료기기 허가 과정
의료기기의 제조 및 유통과정의 요소는 아래와 같이 제조자, 판매업자, 제품으로 단순화 할 수 있다.
한국에서 의료기기를 판매 하기 위해서는 상기 3가지 요소에 대한 허가를 모두 득해야 한다. 이 때, 필요한 허가의 종류는 다음과 같다:
- 판매업자: 제조업/수입업 허가
- 제조업자(공장): KGMP
- 제품: 품목허가
각 요소에 대한 세부 요구사항은 아래와 같다:
1. 제조업/수입업허가
- 의료기기 제조업자나 수입업자에 대해 부여되는 허가. 업허가를 신청하려면 품질책임자를 반드시 선임해야 하는데, 이때 품질책임자는 의료기기법 시행규칙 제11조에서 요구하는 자격 요건을 만족해야 한다: 품질책임자의 자격요건(한국어), 품질책임자의 자격요건(영어)
- 또한, 의료기기 제조 및 품질관리 기준, 수입업자의 준수사항에서 정의하는 바와 같이 적절한 품질 시스템을 운영하여야 한다.
- 세부사항은 관련 법령 참조: 수입업자의 준수사항(한국어), 수입업자의 준수사항(영어)
- 심사기관: 각 지방 식약청
2. KGMP 인증
- 의료기기 제조자 및 제조의뢰자의 품질경영시스템에 대한 심사로, 현지 심사 혹은 서류 심사로 나뉘어 진다.
- MDSAP을 보유하고 있는 제조자라면 최초심사는 서류심사로 갈음될 수 있다.
- 심사기관: 한국 식품의약품안전처 (MFDS) 및 식약처 지정 심사기관 (KTL, KTR, KCL, KTC 등)
3. 품목 허가
- 의료기기의 등급에 따라 품목신고, 품목인증, 품목허가라고 불리우며, 제조 혹은 수입하려는 의료기기의 안전성 및 성능에 대한 평가가 이루어 진다.
- 제품의 안전성 및 성능에 관련된 자료 (IEC 60601, ISO 10993등, 임상시험보고서 등) 제출이 요구된다.
- 심사기관: 한국 식품의약품안전처 (MFDS) 및 식약처 지정 심사기관 (KTL, KTR, KCL, KTC 등)
- 신청하는 의료기기의 등급에 따라 제출자료와 처리기한이 상이하다 :
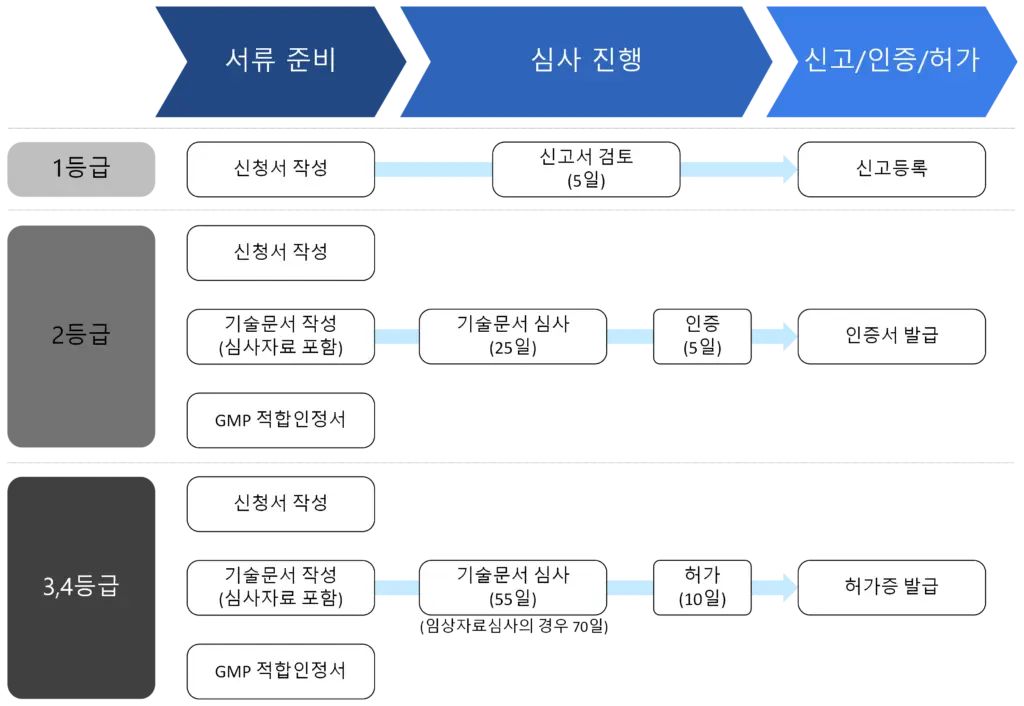
- 허가증의 유효기간은 5년이며, 만료일이 도래하기 전에 허가증의 갱신이 필요하다.
