韩国的医疗器械批准过程
医疗器械的制造和流通过程的要素可以简化为以下三项:制造商、销售商和产品。
在韩国销售医疗器械,必须获得上述三项要素的批准。 所需的批准类型如下:
- 销售商:制造业/进口业许可
- 制造商(工厂):KGMP
- 产品:产品注册 每个要素的详细要求如下:
各个要素的详细要求如下:
1. 制造/进口许可证
- 这是授予医疗器械制造商或进口商的许可证。申请时,须明确指定一名质量责任者,该责任者必须满足《医疗器械法施行细则》第11条规定的资质条件。 质量经理资质(韩语)、 质量经理资质(英语)
- 此外,还需按照医疗器械制造和质量管理规范以及进口商的要求,运行恰当的质量管理系统。
- 详细信息请参阅相关法律法规: 进口商的遵守事项(韩语) 进口商的遵守事项(英语)
- 审核机构: 各地食品药品安全局
2. KGMP认证
- 对医疗器械制造商和委托制造商的质量管理系统进行审查,分为现场审查和文件审查。
- 如果制造商拥有MDSAP认证,初次审查可用文件审查代替。
- 审查机构: 韩国食品药品安全处(MFDS)和食品药品安全处指定的审查机构(KTL、KTR、KCL、KTC等)
3. 产品许可
- 根据医疗器械的等级,分为产品注册、产品认证和产品批准,并对拟生产或进口的医疗器械的安全性和性能进行评估。
- 需要提交与产品的安全性和性能相关的资料(如IEC 60601、ISO 10993、临床试验报告等)。
- 审查机构: 韩国食品药品安全处(MFDS)和食品药品安全处指定的审查机构(KTL、KTR、KCL、KTC等)
- 根据申请的医疗器械等级,提交的材料和处理期限有所不同:
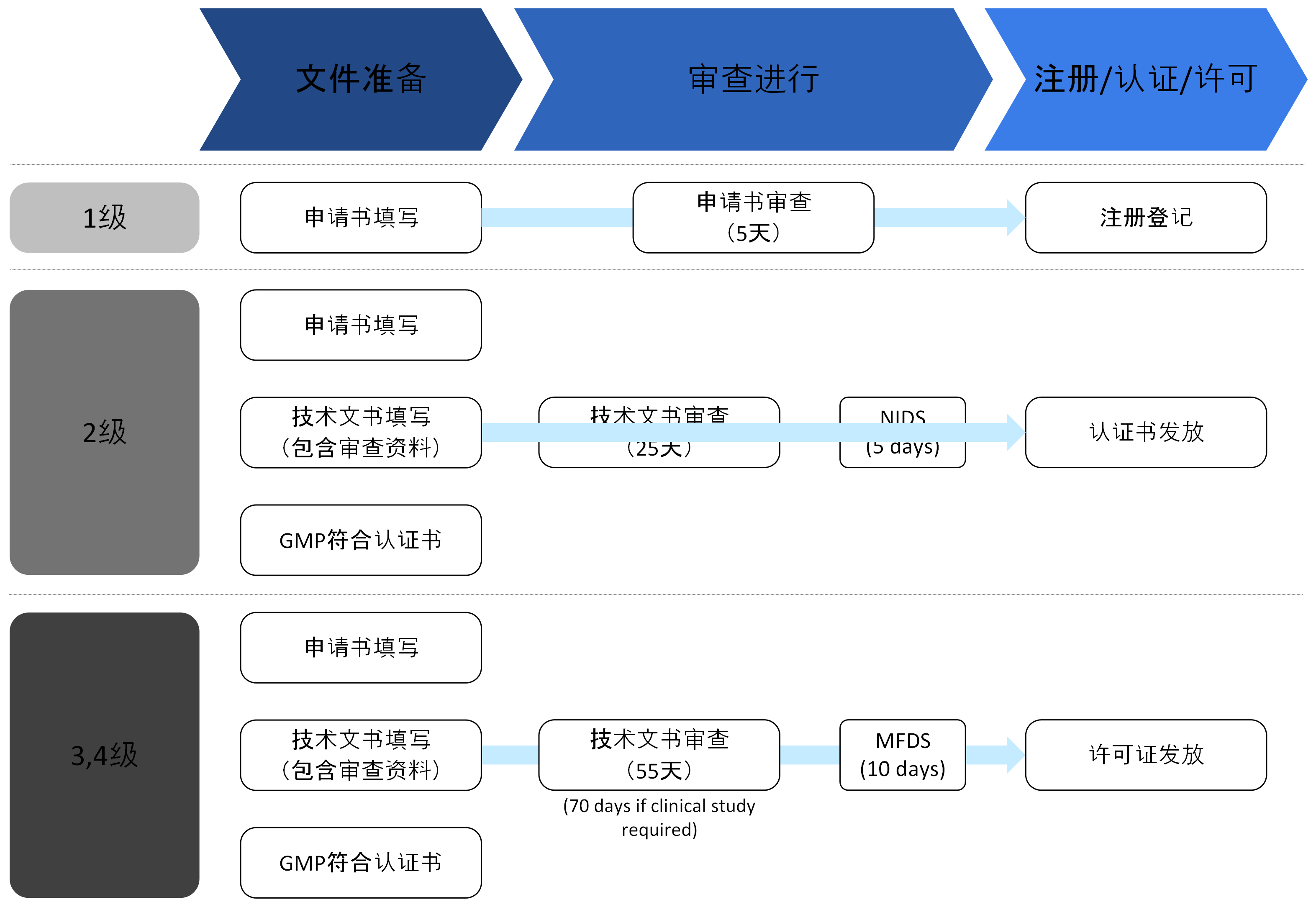
- 许可证的有效期为5年,需在到期日前进行许可证的更新。
