韓国の医療機器承認プロセス
医療機器の製造および流通過程の要素は、以下のように製造業者、販売業者、製品に簡略化できます。
韓国で医療機器を販売するためには、上記の3つの要素に対する承認をすべて取得する必要があります。 この際、必要な承認の種類は以下の通りです:
- 販売業者:製造業/輸入業許可
- 製造業者(工場):KGMP
- 製品:製品登録 各要素に対する詳細な要件は以下の通りです:
各要素に対する詳細な要件は以下の通りです:
1. 製造業/輸入業許可
- 医療機器製造業者または輸入業者に与えられる許可です。許可申請を行うためには、品質責任者を必ず任命しなければならず、その品質責任者は医療機器法施行規則第11条で要求される資格要件を満たす必要があります。 品質責任者の資格要件(韓国語), 品質責任者の資格要件(英語)
- また、医療機器製造および品質管理基準、輸入業者の遵守事項に従い、適切な品質システムを運営する必要があります。
- 詳細については、関連法令を参照してください: 輸入業者の遵守事項(韓国語) 輸入業者の遵守事項(英語)
- 審査機関: 各地方食品医薬品安全庁
2. KGMP認証
- 医療機器製造業者および委託製造業者の品質管理システムの審査で、現地審査または書類審査に分かれます。
- MDSAPを保持している製造業者の場合、初回審査は書類審査で代用されることがあります。
- 審査機関: 韓国食品医薬品安全庁 (MFDS)および食品医薬品安全庁指定審査機関(KTL、KTR、KCL、KTCなど)
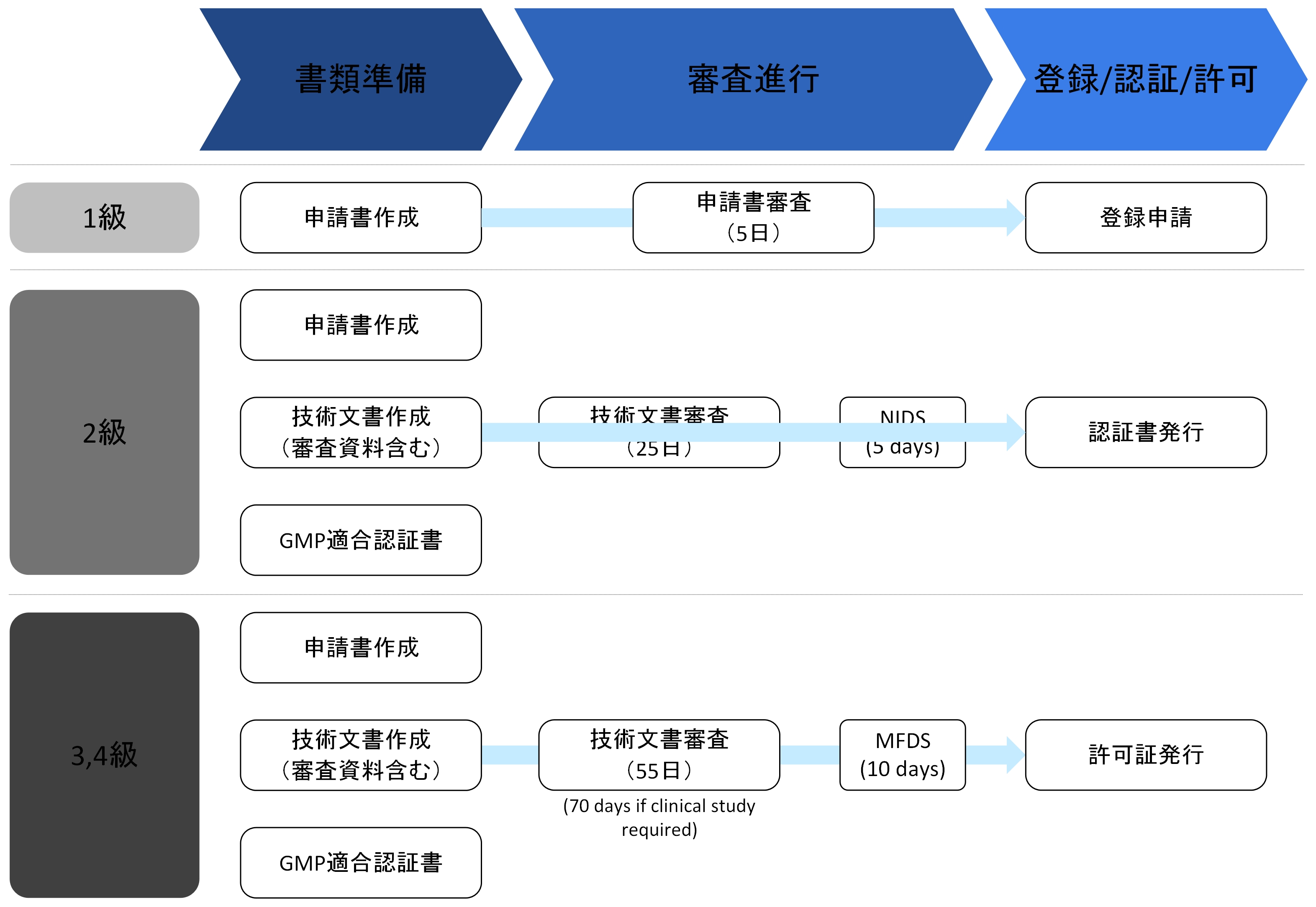
3. 製品許可
- 医療機器の等級に応じて製品登録、製品認証、製品許可と呼ばれ、製造または輸入する医療機器の安全性および性能に関する評価が行われます。
- 製品の安全性および性能に関連する資料(IEC 60601、ISO 10993、臨床試験報告書など)の提出が求められます。
- 審査機関: 韓国食品医薬品安全庁 (MFDS)および食品医薬品安全庁指定審査機関(KTL、KTR、KCL、KTCなど)
- 申請する医療機器の分類により、提出資料および処理期限が異なります:
- 許可証の有効期間は5年であり、期限が到来する前に許可証の更新が必要です。
