韓國的醫療器械批准過程
醫療器械的製造和流通過程的要素可以簡化為以下三項:製造商、銷售商和產品。
在韓國銷售醫療器械,必須獲得上述三項要素的批准。 所需的批准類型如下:
- 銷售商:製造業/進口業許可
- 製造商(工廠):KGMP
- 產品:產品註冊 每個要素的詳細要求如下:
各個要素的詳細要求如下:
1. 製造/進口許可證
- 這是授予醫療器械製造商或進口商的許可證。申請時,須明確指定一名質量責任者,該責任者必須滿足《醫療器械法施行細則》第11條規定的資質條件。 品質主任資格 ( 韓語), 品質主任資格(英語)
- 此外,還需按照醫療器械製造和質量管理規範以及進口商的要求,運行恰當的品質管理系統。
- 詳細信息請參閱相關法律法規: 進口商的遵守事項(韓語) 進口商的遵守事項(英語)
- 審核機構: 各地食品藥品安全局
2. KGMP認證
- 對醫療器械製造商和委託製造商的質量管理系統進行審查,分為現場審查和檔審查。
- 如果製造商擁有MDSAP認證,初次審查可用檔審查代替。
- 審查機構: 韓國食品藥品安全處(MFDS)和食品藥品安全處指定的審查機構(KTL、KTR、KCL、KTC等)
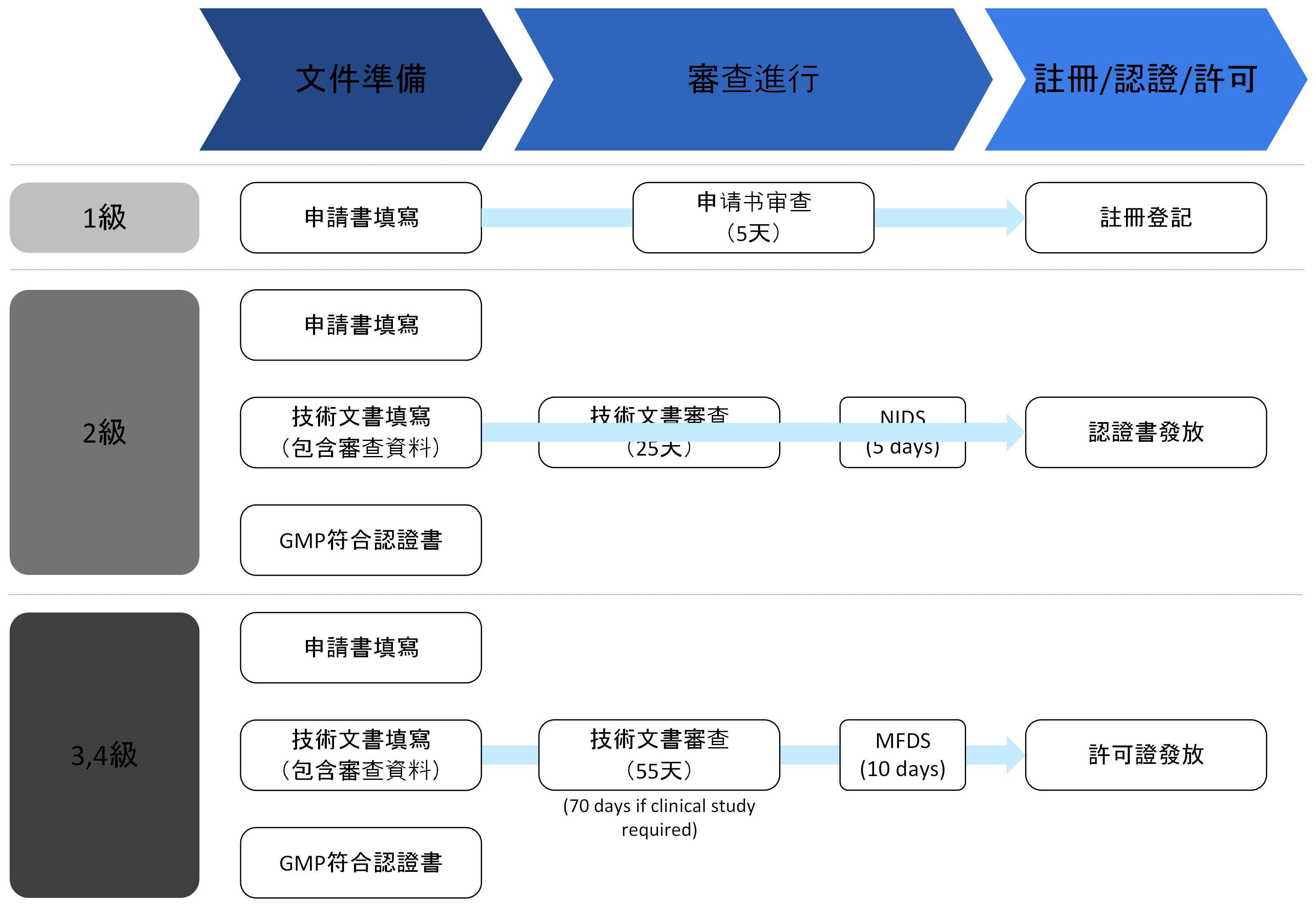
3. 產品許可
- 根據醫療器械的等級,分為產品註冊、產品認證和產品批准,並對擬生產或進口的醫療器械的安全性和性能進行評估。
- 需要提交與產品的安全性和性能相關的資料(如IEC 60601、ISO 10993、臨床試驗報告等)。
- 審查機構: 韓國食品藥品安全處(MFDS)和食品藥品安全處指定的審查機構(KTL、KTR、KCL、KTC等)
- 根據申請的醫療器械等級,提交的材料和處理期限有所不同:
- 許可證的有效期為5年,需在到期日前進行許可證的更新。
